
胃がん
胃がんとは
日本人にとって胃がんはとても身近ながんで、年間死亡者数は約5万人です。がんによる死亡原因として男性では肺がんに次いで2位、女性では大腸がん・肺がんに次いで3位となっています(男性に関しては、かつては胃がんが圧倒的に多かったのですが、近年肺がんが急増し、死亡率が1965年以降減少から横ばいに転じた胃がんに代わって1位となっています。女性に関しては、かつてトップであった胃がん、および第2位であった子宮がんが横ばいから減少に転じたため、胃がんと増加傾向が続く大腸がん・肺がんが上位となっています)。
胃がんの発生過程ではヘリコバクター・ピロリ(Helicobacter pylori)による萎縮性胃炎の関与が示唆されています。また、厚生労働省による研究では、塩分濃度の高い食事を日常的に摂取する人たちは、そうでない人たちに比べて胃がんとなるリスクが高いことや、喫煙による胃がんのリスクの上昇も多くの研究で指摘されています。
胃がんは胃粘膜上皮から発生したがん腫であり、組織学的にはほとんどが腺がんです。稀に内分泌細胞がんなどの特殊なものもありますが、90%以上が腺がんであるとされています。病理学的には以下のように分類されます。
一般型 common type
- 乳頭腺がん(pap:papillary adenocarcinoma)
- 管状腺がん(tub:tubular adenocarcinoma)
- 高分化型(tub1:well differentiated type)
- 中分化型(tub2:moderately differentiated type)
- 低分化腺がん(por:poorly differentiated adenocarcinoma)
- 充実型(por1:solid type)
- 非充実型(por2:non-solid type)
- 印環細胞がん(sig:signet ring cell carcinoma)
- 粘液がん(muc:mucinous adenocarcinoma)
特殊型
- 腺扁平上皮がん(adenosquamous carcinoma)
- 扁平上皮がん(squamous cell carcinoma)
- カルチノイド腫瘍(carcinoid tumor)
- 胃の壁は内側から順に、粘膜層・粘膜筋板・粘膜下層・固有筋層・漿膜下層、漿膜の順に並んでいます。がんが粘膜下層までにとどまっているものを早期胃がん、固有筋層やさらに深くまで浸潤しているものが進行性胃がんになります。
胃がんの症状
早期胃がんの場合に自覚症状はほとんどなく、検診や定期的な内視鏡検査で発見されることがほとんどです。進行していくと、食欲不振・体重減少、吐血や黒色便、貧血、腹痛、嘔吐、といったものが現れるようになります。これらの症状も胃がんに特有のものというわけではありませんので、早期発見には定期的な検診や検査が必要と考えます。
診断・検査
内視鏡検査(胃カメラ)
内視鏡を口あるいは鼻腔から挿入し、胃内を観察する検査です。近年では検診や人間ドックでも内視鏡検査が行われることが増えています。がんの確定診断には組織診(胃の細胞を一部採取して顕微鏡でがんかどうかを調べる)が必要ですが、内視鏡検査で異常があるまたはがんが疑われる場合には、その部分の胃粘膜を採取します。
消化管造影検査(バリウム検査、胃透視)
主に検診などで行われている検査です。バリウムと胃を膨らませる発泡剤を服用していただき、胃の壁に不整やポリープがないかどうかなどを調べる検査です。がんであれば、その形態や進行度を推定する際にも有用です。しかし、小さな胃がんであれば発見が困難であったり、胃炎の変化が強い場合などにその中に小さな胃がんが隠れている場合などがあります。また、良性の潰瘍やポリープであるかどうかは内視鏡検査で組織診をしなければ分からないこともあります。
CT,PET,MRI,腹部超音波検査(腹部エコー)
胃がんそのものの診断をするのは困難ですが、がんのリンパ節転移や遠隔転移(肝臓や肺などの他の臓器への転移)を調べるための検査です。転移の有無によって治療の選択が変わってくるため、内視鏡検査などで胃がんと診断された場合には必要な検査となります。これらの検査を組み合わせて、がんの進行程度(病期,ステージ)を決定します。
超音波内視鏡検査
上述の内視鏡検査と同様ですが、内視鏡の中を通して小さなエコーの機械を胃の中に挿入します。場合によっては内視鏡の先端にエコーの機械が取り付けられた専用の内視鏡を使うこともあります。この検査は、胃がんの深達度(胃の壁の中にどれぐらいがんが深く入り込んでいるか)を調べる検査です。これによって、胃がんの内視鏡的治療が可能かどうかを判断します。
病期(ステージ)
胃がんの進行程度を病期またはステージと言います。下記のように分類され、治療方針を決めるための評価です。
腫瘍の進行程度、壁深達度(T)
- T1 : がんが粘膜(M)、または粘膜下組織(SM)にとどまるもの
- T1a : がんが粘膜(M)にとどまるもの
- T1b : がんが粘膜下組織(SM)にとどまるもの
- T2 : がんが粘膜下組織を越えるが固有筋層(MP)にとどまるもの
- T3 : がんが固有筋層を越えるが漿膜下組織(SS)にとどまるもの
- T4 : がんが漿膜表面に接しているか、それを越えて外側に出ている、または他の臓器に及ぶもの
- T4a : がんが漿膜表面に接しているか、それを越えて外側に出ているもの(SE)
- T4b : がんが直接他の臓器に及ぶもの(SI)
リンパ節転移の程度(N)
- N0 : 近くのリンパ節転移がない
- N1 : 近くのリンパ節に1~2個の転移がある
- N2 : 近くのリンパ節に3~6個の転移がある
- N3 : 近くのリンパ節に7個以上の転移がある
遠隔転移の程度(M因子)
- M0 : 近くのリンパ節以外に転移がない
- M1 : 近くのリンパ節以外に転移がある
進行度分類 StageⅠAからⅣまで決められています。
| N0 | N1 | N2 | N3 | T,NにかかわらずM1 | |
|---|---|---|---|---|---|
| T1a(M),T1b(SM) | ⅠA | ⅠB | ⅡA | ⅡB | Ⅳ |
| T2(MP) | ⅠB | ⅡA | ⅡB | ⅢA | |
| T3(SS) | ⅡA | ⅡB | ⅢA | ⅢB | |
| T4a(SE) | ⅡB | ⅢA | ⅢB | ⅢC | |
| T4b(SI) | ⅢB | ⅢB | ⅢC | ⅢC | |
| T,NにかかわらずM1 | Ⅳ | ||||
※胃癌取り扱い規約第14版より
胃がんの治療
治療には大きく分けて、内視鏡的切除・外科的切除・化学療法があります。
治療法選択のアルゴリズムは下記のようになっています。
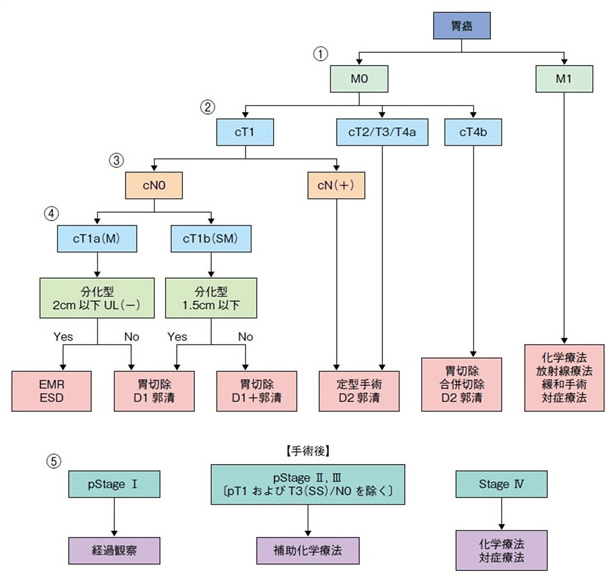
※胃癌治療ガイドライン 第3版より
内視鏡的切除
内視鏡的粘膜切除術 EMR(Endoscopic Mucosal Resection)
胃の粘膜に生理食塩水などを注射して、病変を拳上させてスネアをかけた後に、高周波により焼灼切除します。
▼EMRの手技
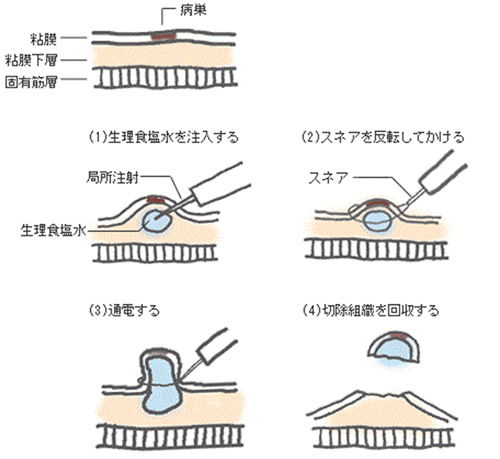
※画像引用:オリンパスおなかの健康ドットコムより
内視鏡的粘膜下層剥離術 ESD(Endoscopic Submucosal Dissection)
高周波ナイフを用いて病巣周囲の粘膜を切開し、さらに粘膜下層を剥離して切除します。
▼ESDの手技
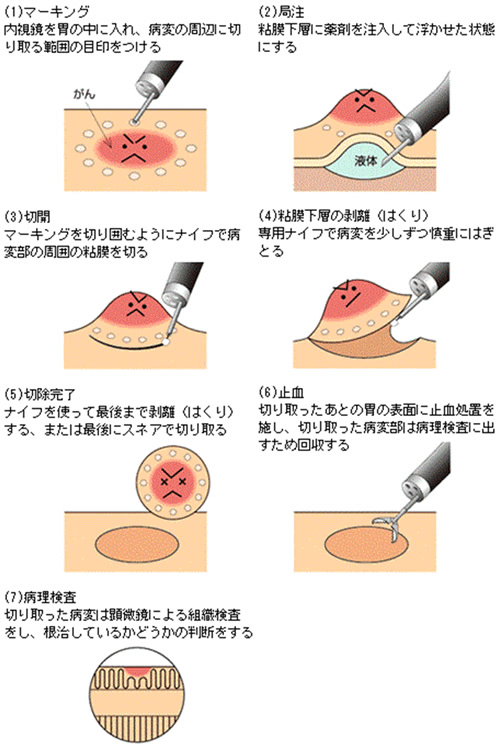
※画像引用:オリンパスおなかの健康ドットコムより
手術(外科的治療)
胃がんに対する手術治療では、胃を切除し同時に、決められた周辺範囲のリンパ節を取り除きます(リンパ節郭清(かくせい))。胃の切除範囲やリンパ節廓清の程度は、病変のある位置や、病期から決定します。さらに胃の切除後の消化管を再建します。手術は最も有効で標準的な治療ですが、リンパ節への転移の可能性がほとんどない場合には、手術ではなく、内視鏡的切除が選択されることもあります。
胃の切除方法、切除範囲
胃の切除範囲は、病変の位置、進行度から決定します。リンパ節転移の可能性がほとんどなくリンパ節郭清がいらないがんでは、手術ではなく、内視鏡的切除が行われます(前述)。リンパ節転移の可能性があるがんに対しては手術が行われますが、病変が噴門(胃の入口)に近い場合は胃全摘を、病変が噴門から離れていれば幽門側胃切除を行います。後者では胃の2/3から4/5程度を切除しますが、噴門は温存され、ある程度の容積の胃は残ります。
リンパ節郭清と周辺臓器の合併切除
がんの病変の壁深達度が増すにつれて、リンパ節転移の頻度は増し、より離れたリンパ節への転移が増えます。早期胃がんでは、リンパ節転移はないか、あっても1次リンパ節に留まることが多いです。進行がんで壁深達度が増せば2次、3次のリンパ節へ転移する頻度が高くなります。進行がんにおける2次リンパ節までの転移頻度は高く、また切除することによる治療効果も高いので、そこまでを切除するD2リンパ節廓清を伴う手術が現在の一般的な手術となっています。
胃の上部に位置する病変の2次リンパ節には、脾臓(ひぞう)のすぐそばのリンパ節や膵尾部(すいびぶ:膵臓のしっぽ)に沿ったリンパ節が含まれるため、膵尾部や脾臓を合併切除することがあります。脾臓は古くなった白血球、血小板、赤血球などを消費する臓器ですが、幼少時には免疫にとって重要な働きを担っていますが、成人ではこれを切除してもあまり心配することはありません。早期胃がんでは原則として脾臓を温存します。
さらに高度な進行がんでは、膵頭部・十二指腸・胆管をともに切除したり、肝臓、横行結腸などを合併切除することがあります。
消化管の再建について
幽門側胃切除後は残った胃(残胃)と十二指腸を直接つなぎ合わせる方法(Billroth(ビルロート)I法)か、十二指腸の断端を閉鎖し、残胃と空腸(上部の小腸)をつなぎ合わせる方法(Billroth II法、Roux-en-Y(ルーワイ)法)で再建されます。再建が単純で、食物の流れが従来と同様であることから、Billroth I法が広く行われてきましたが、近年、Roux-en-Y法を行う施設が増えてきています。
胃の中央部付近にできた特に早期胃がんに対しては、通常の幽門側胃切除ではなく、幽門を温存しできるだけ胃の機能を温存する手術(幽門輪温存胃切除術、PPG)が行われることがあります。幽門の機能を調節する神経を残すことからリンパ節郭清が不充分になるため、進行がんや幽門に近い病変に対しては行われません。この手術では、通常の胃切除後に時に見られるダンピング症候群(後述)が少なく、良好な体重の回復が見込まれるとされています。
胃全摘後では、食道と空腸(上部の小腸)をつなぎ合わせ、十二指腸断端は閉鎖してしまう方法(Roux-en-Y法)が最も広く行われています。
胃全摘や幽門側胃切除後のどの再建法においても、幽門における食物の流れを調節する機能は再建できないため、結果大きな差を認めません。術後の食事摂取や栄養吸収に関しては、幽門側胃切除が胃全摘に比べ良好なようですが、消化吸収は小腸が担っているため、胃全摘後であっても社会復帰に困ることはありません。
胃がん手術の合併症
胃がんの手術の合併症として多いものとして、膵臓周辺のリンパ節を郭清することに付随した膵液瘻(すいえきろう:膵臓の分泌液である膵液が一時的に漏れる状態)と消化管をつなぎあわせた部分に綻びをおこす縫合不全が挙げられ、これらの合併症では治療が奏功しない場合には死亡につながる可能性があります。
膵液瘻は、膵尾部と脾臓を切除した場合には約40%に、膵臓を温存し周辺のリンパ節と脾臓を切除した場合は約20%にみられます。幽門側胃切除においては膵液瘻はまれにしかみられません。
胃全摘における食道・空腸吻合における縫合不全は、手縫い吻合が行われていた時代には4%程度にみられましたが、自動吻合器による器械吻合が普及してからはその発生頻度は少なくなりました。幽門側胃切除後の胃と十二指腸を直接つなぐBillroth I法における縫合不全は2~3%にみられますが、胃と空腸をつなぐBillroth II法やRoux-en-Y法においてはほとんどみられません。
その他の合併症として、創部の感染や腸閉塞、肺炎、出血などがそれぞれ1~2%にみられます。
また手術の一般的な合併症として、いわゆる「エコノミークラス症候群」として知られる深部静脈血栓症とこれに伴う肺塞栓症(静脈に生じた血栓(血の塊り)が流れ出して肺の血管を塞ぐこと)があり、近年増加傾向を示しており、その予防法として手術中・直後の安静期間に弾性ストッキングやマッサージ器の装着、さらには抗凝固剤(血を固まりにくくする薬剤、ヘパリンなど)の使用が行われています。
手術後の在院死率(手術後一度も退院できずに死亡する割合)としては、胃全摘後で1%、幽門側胃切除後で0.2%です。
胃切除後の後遺症:小胃症状・ダンピング症候群
胃切除術によって最も影響を受けるのは食生活です。
胃全摘や幽門側胃切除では、「速やかに相当量の食物を受けつけ、それらを一定時間蓄えて効率よく徐々に腸に送り出す」というリザーバーとしての胃の本来の役割が障害されてしまいますので、食物を大量に速く食べることが困難になり、同時に早くおなかがすくようになります。
胃の出口が開放状態になっているため、食べ物が急速に小腸へ流れ込み消化吸収され、血液中の糖分の値(血糖値)は急激に上昇します。それに反応し、血糖値を下げるホルモンであるインシュリンが大量に分泌されるため一定時間後には血糖値が下がり始めますが、その頃には食べた食物はほとんど吸収されてしまっており、血糖値は必要以上に下がってしまいます。食後2~3時間において突然脱力感、冷汗、倦怠感、集中力の途絶、めまい、手指の震え、またまれに意識が遠のくようなことが起こることがあります。これらを後期あるいは晩期ダンピング症候群と呼びます。これを予防する方法としては、食後約2時間の間食が効果的です。これに対し、食事中から食後30分以内に発現する動悸、発汗、めまい、眠気、腹鳴(おなかがごろごろ鳴ること)、脱力感、顔面紅潮や蒼白、下痢などを、早期ダンピング症候群と呼びます。これは糖分の濃い食物が腸に流れ込み、その浸透圧に反応し急激に多量の腸液や特殊なホルモンが分泌されて起こる現象とされています。従って、ぜんざいなどの流動性が高く甘味の強いものを急激に摂ることで起こしやすく、また食事中の過剰な水分摂取も原因になりえます。食事中の過度の水分摂取は食事量を減らすことにもつながるため、できるだけ避け、食後1時間程度で水分補給をするのがよいでしょう。
この他には、術後20~30%の頻度で胆石が発生し、またカルシウムや鉄分の吸収が悪くなるといわれています。特に閉経後の女性では、胃全摘後に骨の変化が出やすいようです。
胃切除術後の食事についてのアドバイス
食事内容としては、炭水化物や糖分を多く含んだ食物の摂取をややひかえることです。胃全摘後では食道に小腸がつながっています。食物が早く通過する食道と、ゆっくり停滞しながら少しずつ流れる小腸との吻合部では、しばしば食物が滞ります。手術後時間の経過とともに食物の通過は改善しますが、あわてて食事をすると食物がひっかかってしまい、嘔吐したり不快感に苦しむことがあります。食事はゆっくり摂ることを心がけ、また鉄分やカルシウムを多く含んだ食物を摂るように心がける必要があります。
腹腔鏡(補助)下胃切除術
腹腔鏡下手術は、腹部に小さい穴を数ヵ所開けて、専用のカメラが映し出す映像を見ながら専用の器械を用いて行う手術です。開腹手術に比べ、体への負担が少なく、手術後の回復が早いため、手術件数は増加しています。開腹手術と比べて、リンパ節郭清や消化管を再建する技術が十分に確立しているとの検証がなされていないが、十分な経験をもつ施設においては早期がんを中心に、一部では進行がんに対しても、胃がんに対する腹腔鏡下手術が行われているのが現状です。(2010年版の胃がん治療ガイドラインでは、胃がんの腹腔鏡下手術はステージIの胃がんへの臨床研究として行うべき治療として位置づけられています。)
化学療法
いわゆる抗がん剤による治療です。
切除不能進行・再発胃がんに対する化学療法は、最近の進歩により高い効果が得られるようになっています。全身状態や主要臓器機能(骨髄・肝機能・腎機能)などを考慮し、使用する抗がん剤の種類や量を決定します。
単剤あるいは併用療法として主に用いられる薬剤として、フルオロウラシル(5‐FU)、シスプラチン、塩酸イリノテカン(トポテシン、カンプト)、ドセタキセル(タキソテール)、パクリタキセル(タキソール)、テガフール/ウラシル合剤(UFT)、5’-ドキシフルリジン(フルツロン)、S-1(TS-1)などがあります。
ACCESS交通案内
〒569-1192
大阪府高槻市古曽部町1丁目3番13号
交通案内情報を見る
- TEL072-681-3801
- FAX072-682-3834

電車でご来院の方
-
JR高槻駅徒歩9分、阪急高槻市駅徒歩15分
車でお越しの方
-
高槻病院西駐車場、
愛仁会リハビリテーション病院
地下第1駐車場がございます。




